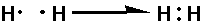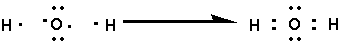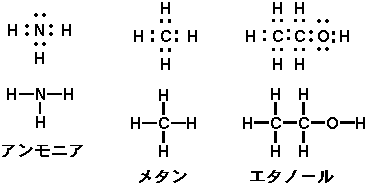からむこらむ
〜その15:原子の「手」〜
まず最初に......
こんにちは。春だなぁ、と最近良く思う管理人です。でも、今日は予想最高気温が夏日手前.......(^^;;
さて、前回は見事に二極化しましたので(「文章力の問題」とも言う........)、ちょっと「ひいて」みようかとおもいます(ちょっと「基本」が続くのは申し訳ないですm(__)m でも、ここら辺を抜けると...........)。
そう、今回は「原子」の話。と言っても、あまり基本過ぎることをやっても仕様がないですので、ちょっと進めた話。 そうそう、良く世間で出てきた「活性酸素」なんて言うのも出ます。
あと、出来ましたら「元素周期表」が手元にあると理解がしやすいです。持っていましたら御用意を。それでも無いときは.........ここにもあります(出来たら、質量数とかあるほうが良いので、こちらは当てにしないほうが良いです)。
それでは「原子の「手」」の始まり始まり........
世の中の「物質」と言われるものは、現在の化学の知るかぎり全て「原子」で構成されている、とされています。そう、今あなたの見ているディスプレイやコンピュータも、そしてあなた自身も原子の集まりです(まぁ、宗教論争は飛ばして)。
では、「原子」という物をどれだけ御存知でしょうか?
「原子(atom)」という概念は結構古く、紀元前500年頃のギリシア時代にレウキッポス(Leuchippos)とデモクリトス(Democritos....."e"の上にはラインが本当はあります)の二人の哲学者が確立したとされています。あんまり詳しく書いても凡俗な私には良く分からないので簡単に書くと、「宇宙を空虚な空間と無数の微粒子よりなるものとし、分割できない究極的粒子には、形と大きさの異なる多くの種類があり、同種の粒子は結合して物質を形作る.......」という考えでした。そして、この「粒子」を「アトム(atomos」.........「分割できないもの」の意味をもつ言葉を名付けました。 そう、これは我々の知るかぎりの原子に「近い」形の概念になります(2500年も前に!!)。
が、しかし! この説はかの有名な哲学者「アリストテレス」の説に抑圧(邪魔)されて、結局広まりませんでした。
結局、「現代の」原子概念の基礎が確立されたのは..........何と19世紀。「ドルトン」によります(ラボアジエの「質量保存則」と、プルーストの「定比例の法則」を元に築く)。
さて、では原子の構造やら、諸々と復習してみましょうか。
原子は3つの素粒子で成立しています.........そう、「陽子」「中性子」「電子」です(最近の「クオーク」は取りあえず「無し」としてください)。 原子には「原子核」があり、これは陽子と中性子で構成されている(水素は陽子のみですが)。そして、その原子核の周辺を電子が回っている..........ここまではOKですね?
そして、原子番号やら原子量はこれらの素粒子が関与する事を思い出してください。「原子番号」は陽子と同数=電子と同数です。そして、原子量は「陽子数(=電子数)+中性子数」です。OKですね?
では、電子は原子核の周りを「層」をなしている事は御存知でしょうか?(一応、高校ではやります.........)
「陽子」と「中性子」で構成される「原子核」の周辺には、陽子と同数の「電子」が回っています。 その電子、実は「層」をなして回っているのです。
これを説明しますと、原子核にいちばん近い層では電子が2個入る「層」があり、その外側には電子が8個、その外側には18個、その外側では32個、50個、72個..........と、電子が入る「層」があります。そう、覚えている方には分かるのですが、その「層」を内側より「K殻」「L殻」「M殻」「N殻」........と読んでいます。
この「殻」......「電子殻」には、2n2個の電子が入る様になっており、現在知られている元素までを見てみると、「Q殻」まであります(何故「K」から始まるかは知りません)。
さて、この「電子殻」ですが、実際の様子を書いてみましょう。
一番軽い水素(H)では、「原子番号1 質量数1」です。つまり、陽子1個と電子1個で成り立つ原子です。 この水素の電子は、原子核にいちばん近い「K殻」を回っています。
次に2番目に軽い原子ヘリウム(He)を見てみましょう。 この原子は「原子番号2 質量数4」です。 つまり、陽子2個(=電子2個)と、4−2=2個の中性子で構成されています。 つまり原子核は「陽子2個+中性子2個」で成り立っており、その周りを電子が2個回っている構造になります。 この電子は.......「K殻」には2個の電子が入る事が出来るので、この2個の電子は「K殻」に入ります。
次に3番目の原子リチウム(Li) を見ましょう。 この原子は「原子番号3 質量数(約)7」です。 さて、ここで上記のように行けば、「K殻」は3個の電子の内2個が入ります........が、ここで1個電子が余ります。 この電子はどうなるでしょう? 答えは「一個上の殻へ移る」.......つまり、「K殻」の次、「L殻」へ電子が移行します。ここで、「K殻」へ3個目の電子は入ることは出来ません(「K殻」は「閉殻」したという)。
後はこれのくりかえしとなります。 尚、「電子が入っているもっとも外の殻」に入っている電子数を「最外殻電子数」と読んでいます。つまり、上記例では水素は「最外殻」にある電子は、「K殻」に1個ですので、「最外角電子数」は1、ヘリウムでは「K殻」に2個ですので、「最外殻電子数」は2、リチウムでは一番外側の「L殻」に1個ですので、「最外殻電子数」は1........と言った具合です(これが重要になる)。
しかし、「法則」という物があります。例を挙げてみましょう。
周期表の1番右.........今なら「18族」、昔なら「0族」と呼ばれた原子がありますが、こいつらには共通して「最外殻電子数が8個になる」という法則があります(ヘリウムは例外。K殻に2個しか入らないから)。
そして、この「殻」ですが、「K殻に2個入ったらL殻へ。L殻で8個入ったらM殻へ」.......と順番に増えるのですが、「M殻に18個入ったらN殻へ。N殻で32個入ったら..........」とはなりません。非常にひねくれています。
これは、順番に埋めていけば分かるのですが、18番目の元素アルゴン「Ar」ではK、L殻は閉殻(ここで10個分の電子)し、残る8個はM殻にあります。 ここで、M殻は「2n2の電子」が入ることに基づけば、Mは3番目ですので18個の原子が入ることとなるのですが、次の19番目の元素カリウム「K」では何と、M殻の外の「N殻」に電子が入り始めてしまいます。 その次の20番目カルシウム「Ca」もN殻へ入ります.........
しかし、都合の良いことに、有機化学ではカルシウムまでと、17族(昔の7B族)......つまり「ハロゲン」(塩素、臭素、ヨウ素」を覚えていれば不都合は無かったりします。これはどういうことかと言いますと、元素の周期表を見れば分かりますが、「横1列が8個」の原子群の元素までで事足りる事、そして、その「左」から順に「最外角電子数」が一番左を「1」として、右に行くごとに「1」ずつ増えていき、そして18族で最外角電子数が8個になるという事です(周期表を見ると簡単です。教科書があるともっと簡単です)。
例:第二〜三周期(周期表の上から二番目の列) 「元素記号:最外角電子数」
Li:1 Be:2 B:3 C:4 N:5 O:6 F: 7 Ne:8 Na:1 Mg:2 Al:3 Si:4 P:5 S:6 Cl:7 Ar:8 ←実際に計算すると絶対に分かります!!
さて、上でごちゃごちゃ書いていても「分かりにくい」ので、ちょっと切り替えましょう。
「イオン(ion)」という物を覚えているでしょうか? そう、原子の右上に「+」とか「-」とかついている「あれ」です。
おそらく中学までは(もちろん、カリキュラムの問題もあるので一概には言えませんが)「ナトリウムはイオンになるとNa+と書き、1価のイオンです」とか覚えさせられましたが、これはどういう事でしょうか?
元素周期表を見ますと、ナトリウム(Na)は「原子番号11 原子量23」です。つまり電子は11個。 電子殻を見ると、K殻2個にL殻8個で10個。そして残り1個がM殻に入っています。 しかし、ナトリウムはその「性格」から「イオンになりたがる」傾向があります。どうするか?
イオンの「電子の様子」だけを見ると、共通して「18族(0族)と同じ」という事が挙げられます(あくまでも「電子の様子」のみ。原子そのものでは無いです)。つまり、最外殻電子数が8個(または2個)あると言うことです。 ナトリウムを考えると、これの最外殻電子数を8個とするには.........「M殻にある電子を1個をなくす」か、「M殻に7個電子を入れる」かになります............そう、どちらが「楽に」出来るかは容易に想像できると思います。答えは前者です。
これによってM殻から電子1個を放出したナトリウムは、その電子が1個無くなったために「+」の電荷を持つ「イオン」、「ナトリウムイオン」になります(電子は「−」の電荷をもつでしょう?)。
「マイナスの電荷を持つイオン」も基本的には同じことです。もっともこちらは「電子を受け入れる」ので、「マイナスイオン」になります。
尚、「イオンになりたがる傾向」は「イオン化傾向」と言う名前で覚えている方もいると思います。その傾向は、
K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
です。ごろ合わせで覚えた方もいらっしゃると思います。(「金借りるな、間借り当てにするな、ひどすぎる借金」というのが、管理人の言っていた高校での覚え方(^^;)
さて、最外殻電子数に注目するものがもう一つあります。
皆さんは「共有結合」という物を覚えていらっしゃるでしょうか? これが有機化学では「基本」となる結合です。 これはつまり、世の中にある物質は「原子」そのもので存在するものが極めて少なく、そして基本的には「分子」という物が多いことに起因しています(簡単に言うと、「水素原子」で存在するものよりも、「水素分子」で存在する物の方が多いという事を考えて頂ければ分かりやすいと思います..........)
この結合は、要は「最外殻電子を他の原子の最外殻電子と仲良く共有する」という結合です。
例を挙げてみましょう。
水素分子は「H2」と書くように、「水素原子が2個」で成り立つ分子です。この分子は「二つの原子が」共有結合しているものです。
水素原子では、K殻に1個の電子が存在しているのは記述した通りですが、実はその状態のままだと水素は「不安定」な物となります。どうするか? これを安定化するには、「最外殻電子の数を満たす」と安定するのですが、これをするためにもう一個の水素原子と協力することとなります。
では、その協力とは何か? お互いの水素原子が、自分の最外殻電子を「共有」してやる事です。図にして見ると、以下のようになります。
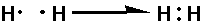
上の図では「・」が最外殻電子を指しています。 こういった感じで「お互いの最外殻電子を一個ずつ提供して成り立つ結合」を「共有結合」と呼びます。
実際には「H-H」のような感じで表記します。そして、「これ」が「原子の手」となります。
もう少し例を挙げてみましょうか。水は「H2O」ですが、これは「H-O-H」の様な構造を持ちますが、上記の様な方法で書くと、以下の図のような形になります。
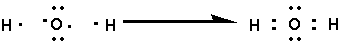
酸素の原子数は8 原子量は16です。つまり、電子は8個持っており、2個はK殻に、そして残り6個がL殻にあることから、「最外殻電子数」は6と言えます。よって、「・」が6個ありますが、「6個全てが独立」ではなく、2個の電子がペアになって存在しているものが二つ、1個が独立してあるものが二つあります。ここで、「2個がペア」になっているものを「非共有電子対」、1個だけ独立しているものを「不対電子」と呼びます。
ここで注目なのが、「なるべく8個」になるよう(=最外殻電子が満たされるように)なっていることです。 これが「ミソ」になります。
後はいくつか例を挙げましょう。
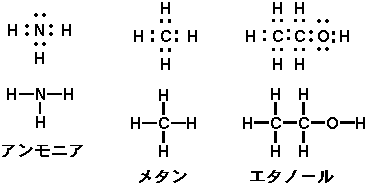
炭素の最外殻電子は4つ、窒素の最外殻電子は5個です..........ちょっとパズルですが..............
こういった原子の「手」となるべき最外殻電子数の数から「原子価」という言葉があります。これは早い話、「原子の不対電子の数」であり(つまり、「非共有原子対」は入らない)、水素は1 ハロゲン(塩素、フッ素など.......最外殻電子数は7)は1 窒素は3 酸素、イオウは2 炭素は4となります(上の図と比べて見れば分かりやすいです)。
さて、長くなりましたので、次で最後に。
上記の様な話をしましたが、もし原子が他の原子と「うまく共有結合できなかったら」どうなるでしょうか?
これは「不対電子」が丸出しの形で(ちょうど水素ならば、上の「水素分子」の説明の図の左側のままということ)存在することとなります。こういった物質は極めて不安定(=反応性が高い)物質となり、これを「遊離基」または「ラジカル」と呼びます(free radical)。これは原子のみでなく、官能基(functional group:「水酸基」-OH や、フェニル基など......)にも存在します。
さて、このラジカルは、まさに「radical」な性質で恐ろしいほどの反応性を持つために、さまざまな分子を「破壊」する特長があります。この例をいくつか挙げますと.........
- 漂白作用を持つ(花びらを入れると、あっという間に真っ白になります........怖いぐらい)
- フランスではオゾン(O3)、二本では次亜塩素酸(HClO)による水道の殺菌の例の様に、殺菌作用を持ちます。 また、雷の後空気が「すがすがしい」のは、放電作用によるオゾンの生成の為です。
- (有機化学ネタですが)二重結合の破壊によるオゾニドの生成と、分解による構造の同定が可能。
1番最初の例は、「色素」をラジカルが破壊します。 2番目の例は、皆さんが良く接する物でしょう。オゾンは「遊離酸素」を、次亜塩素酸」は「遊離塩素」を生成します(日本の水道の塩素検出はこの為)。雷の例は、そのオゾンがにおいなどの物質を破壊するためです。 3番目の例は.......化学屋さんだけしか分からないか。「構造の分からない物質」を調べるときの「手がかり」の一つとして用います。
さて、以上の例は「まぁ、普通の」例ですが、ちょっと怖い話を二つほど。
農薬の一つに「パラコート」という除草剤があります。この農薬は非常に変わっていて、「光にあたる」事でその効果を発揮します。 さて、日本における自殺方法で「農薬を飲む」というケースがありますが、一時期(今もか?)このパラコートによる自殺者が(農薬自殺では)一番多いというデータがありました。
さて、このパラコートという農薬は日が沈んでから、「これから作物を作ろうとする耕作地」に散布します。そうすると、雑草等が夜の間にこの農薬を吸収します。 そして朝.......「光」が当たりますと、このパラコートは「遊離基」を発生させます.........そして、そこで発生したラジカルが、片っ端から細胞を破壊してゆき、そして最終的にはからせてしまうという農薬です(そうして雑草を一掃してから作物を作る)。 さて、これが人間の体内だと..........おお.....こわ (>_<)
さらにもう一つですが、一時期「活性酸素が云々」とよく騒がれましたが、その「活性酸素」はつまりのところ「遊離酸素」........「ラジカルな酸素」の事になります。
この遊離酸素は体内で「必ず」出来るもので、老化の原因にもなります。これはつまり、若い間はこのラジカルを除去できる能力が高いのですが、年を追うごとにその能力が減衰していくことによるものです。
尚、このラジカルを体内で除去するものとして、ビタミン類(A,E等)や、SOD(Super Oxide Dismtase 「スーパーオキシドディスムターゼ」)と呼ばれる酵素があり、これらを称して「ラジカルスカベンジャー」と呼びます(「スカベンジャー」は「掃除屋」の事。 「戦隊物」みたいな名前ですが、本当です)。
では、長くなりましたのでこれまでで.............
●1999/11/02 補足
「KEN」さん(こちらの方ではありません(^^;)とおっしゃる方より、「何故K殻から始まるのか」という事に関してメールを頂きました。それによりますと、
「端的に言えば、発見者が謙虚だったためであり、発見者が見つけた電子軌道(K殻)の内側にあきがあるので、そこにも電子軌道があるだろうと予測したため、K殻から始まった」(管理人要約)
との事です。
ありがとうございますm(__)m
あぁ.......長い.......... 何だか高校の復習ですね............
さて、今回の「からこら」は如何だったでしょうか? もはや「高校化学の復習」+「余談」になってしまいましたが........... これで記憶の底から掘り起こしていただければ嬉しいです。
取りあえず、今回は「復習」メインでやりました。ら、長くなってしまいました。 ま、軽く流している........つもりなのですが(^^;;
ただ、今回やった事は必ず「後で」響いてきます。「だいたい」で良いですので、御理解いただければ嬉しいです。
#でも、やはり難しいかな........? これ以上は...........
#しかし、これで「薬」関係のお話へ第一歩です。(^^)
次回は........次回は、「基本」話はしないつもりです。「失われた番号」の話でもしようかと思っています。そう、雑学的なものの予定です。お楽しみに
それではすっかり春めいてきましたが、皆さん楽しくお過ごしくださいませ。
(1999/04/13記述 同11/02補足)
前回分 次回分
からむこらむトップへ