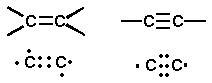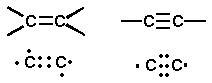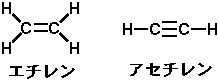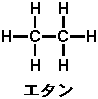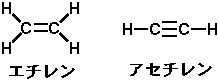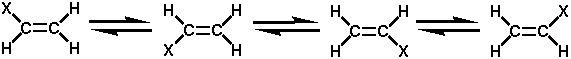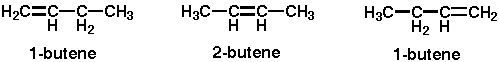からむこらむ
〜その19:炭素と構造(2)〜
まず最初に......
こんにちは。ちょっと風邪っぽい管理人です。案の定、7度の熱...........(~_~;; 皆様如何お過ごしでしょうか。
さて、今回は前回の続きの「基本話」。
有機化合物の「骨格」は、前回説明したような「アルカン」だけなのでしょうか? いや、もっと膨らませることが可能になっています。 今回はそのお話であります。
なんというか、高校の復習なんですけど、まぁ、あまり難しく考えないで「こんなものだ」という事でよろしいかとは思うのですが.........
それでは、「炭素と構造(2)」の始まり始まり..........
さて、前回までは「炭素の手」についてお話しました。 しかし、そこではあくまでも「炭素」と「炭素」の間は「一本の手」で結ばれており、そして「炭素と水素」の間も「一本の手」で結ばれていました。
でも、原子と原子の間の「手」は一本である必要はあるのでしょうか? 例えば、前回までの様なアルカンの「手」は全て「一個の電子を出し合って」共有結合をしていますが、もしこれが「最外殻電子数から2個の電子を出し合って」、「3個の電子を出し合って」という事は可能なのでしょうか?
そう、答えは可能なんです。ではそうなったらどうなるでしょうか? それは、以下に上げる例の様になります。
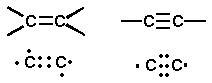
上が「構造式」、下は「電子の状態」になります。
左は、「不対電子を2個」出し合ってお互いで共有を、右は「3個」出し合ってお互いに共有した時です。 そう、つまり必ずしも「一本の手」で繋がっているわけでは無いのです。
左の図の様に「手を二本出し合って出来た」結合を「二重結合」と呼び、この結合を持つ炭化水素化合物を総称して「アルケン(alkene)」と呼びます。 そして、右の図の様に「三本の手を出し合ってできた」結合を「三重結合」と呼び、この結合を持つ炭化水素化合物を総称して「アルキン(alkyne)」と呼びます。
また、上記のようなアルケン、アルキンを「不飽和炭化水素化合物」と呼びます(「単結合」のみに使われる「飽和炭化水素化合物」という名称と対比をなします)。 ただし、いずれの場合も、「炭素が4本の手を持つ」事に変わりはありません(←これ、重要です)。つまり、「その手の使い方」が異なっているだけです。
以下に、もっとも簡単なアルケンとアルキンについて、そのもっとも簡単な物質の構造と名称を示します。
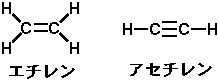
左のアルケンは聞いたことがあるかと思います。 この「エチレン」という物は果実等が熟すのを促進させる働きがあります。 また、この物質をたくさん並べてくっつけることによって、「ポリエチレン」と言った樹脂を作ることも出来ます(「poly」=「たくさん」:こちらの話の最後に出したのを思い出してください)。
そして右のアルキンについても聞いたことがあるかと思います。 この「アセチレン」は「アセチレンランプ」に使われる「アセチレン」です。中原中也の詩にも出てきますね。
尚、結合の名称についてですが、上記の物は「二重結合」「三重結合」と言いました。 そして、今までの「一本で結ぶ結合」は「単結合」と呼んでいますので、覚えておいてください。
さて、ところで「単結合」「二重結合」「三重結合」があったところで、「四重結合」はあるのでしょうか? そう、炭素のもつ「4本の手」を全部もう一つの炭素との結合に費やせるかという事ですが.........答えは、「出来ません」。 非常に物理的に難しくなっています。
もっとも、「目茶苦茶な(例えば宇宙創世の頃の様な)条件」では出来るかも知れませんけど...........まぁ、普通に知られているような状態なら極めて難しいです。
※:これを説明するには、大学理化学レベルの量子力学に軌道論が絡むので省略します(混成軌道を考えればわかるのですが........(^^;;)
さて、世の中の化合物を簡単にみていくと、さまざまな物質は、「単結合」「二重結合」「三重結合」をその構造の中に入れている物が多く、それがまた重要な役割を果たしているケースが多くみられます(構造的にも、代謝的にも)。
ここで、この三種類の結合の「立体構造」について軽く触れておきましょう。
二番目に単純なアルカンである(つまり、炭素が2個の飽和炭化水素)「エタン」(C2H6)は下の図のように、炭素-炭素間で単結合を行い、残る3本の手を水素と結合しています。つまり、全て単結合で成り立っている化合物です。
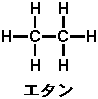
ここで前回を思い出してみてください。 本当にエタンというものはこんな「平面な」構造なのでしょうか? 答えは前回に書いたように「違います」。 実際には「立体的」な構造をしており、以下の図のような構造を取っているのです(水素は省略されています)。
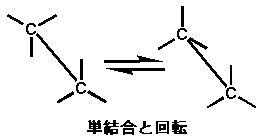
そう、実は上のような立体的な構造を取るとともに、「回転」をしています。これは単純に「単結合」というものの性質として「回転する」という特長があるからです(実際には、「安定性」の問題がエネルギー的にあるので、図の右よりも左の方が存在している比率が高くなっています)。 しかも、上は単純なエタンですが、もっと炭素鎖が長くなり、しかも枝分かれをしていたりすると...........ここでは書きませんが、(前回書いたような)非常に「くねくね」とした立体構造を取ります(これが生体内ではキーとなる)。
では、二重結合と三重結合はどうでしょうか?
取りあえず、上の図をもう一度こちらに描いておきましょう。
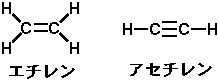
さぁ、この両者の場合どうなるか?
まず、左のアルケンをみてみますと、C2H4の「エチレン」という化合物です。この立体構造は? ..........実は二重結合は単結合のように「回転できない」為、「このまま」になります。つまり、「平面」な構造になっており、アルケンのような「回転する」ような立体構造はありません。 つまり、エタンは「ぼこぼこ」の構造ですが、エチレンには「でこぼこ」は無く、横から見たら「平らな構造」となっています(身近なもので例えれば「レンチ」みたいなものでしょうか?)。
次に、右のアルキンをみてみますと、C2H2の「アセチレン」という化合物です。 この立体構造は? .........実はこれも単純。この場合は「まっすぐ」です。一直線で、「串」みたいな物でしょうか。 非常に単純な構造を取っています。
ただし、アルケンの構造には、少し「深い」問題があります。 それは「二重結合を持つが故」の特長でもあります。
例を挙げましょう。
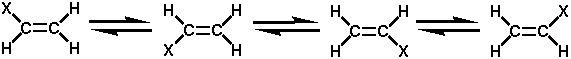
上記の例を見てください。エチレンの水素(H)一個を「X」に置き換えたもの(例えば「塩素」や「臭素」)です。上の4つはいずれも同じ構造なのはわかっていただけるでしょうか?(色々と回転させてみてください)。
では、Xが「2個」になったら.......?

上に描いた物質の化学式はいずれも「C2H2X2」です。
さて、構造を見てみますと、左の二個の構造は一緒です。 そして、右の二個の構造もまた一緒です。 しかし、右と左の構造は.........違ってきます。
アルケンが「平面」であると同時に、「二重結合が回転できない」性質であることを考慮に入れて考えてみましょう。 左の構造式と右の構造式は一致するか考えてみてください。 例えば、鏡の.......そう、「鏡像」のような物を想像してみても、確実に一致はしませんし、右に左に何度回転させても、また一致しません............ これは、アルケンの大きな特長の一つになっています。
上記のように、「式は一緒だが構造が異なる」様なものを「異性体」と呼んでいます。 異性体には、大きく「構造異性体」と「立体異性体」があります。 今回挙げた例は「立体異性体」の一つで、特に「幾何異性体」と呼んでいます。
尚、左のように、「一方に」あるようなものを「cis(シス)型」。 また右のように「互い違い」のようなものを「trans(トランス)型」と呼びます。これより特に「シス−トランス異性体」とも呼びます。
一般的にtrans型が構造的には安定しています。
こういった「構造の問題」は実際に、自然界に存在するようなものや、人工的に作ったものなどに対して(文字通り)「複雑に」絡んでおり、特に「異性体」と言うものは「大きく」絡んできています。
簡単に例を挙げましょう。 一部の農薬は構造中にこの「二重結合」を含んでおり、研究の結果「シス型」と「トランス型」でその殺虫能力が異なることが知られています。 また、薬品(いわゆる「薬」等)もこういった問題は起きており、二種類の「異性体」が起こした「全く性格の異なる」薬効による事件もあったりします。
まぁ、こういった問題は..............また別の機会にしましょう。 もう少し基本を踏まえてから触れますので.............
※追加分:アルケン・アルキンの命名法
アルカンではその14で述べたように、「炭素の数」の最後に「-ane」をつけるようになっています(C1からC4までは少し違いますが........)。
そして、アルケンとアルキンもまた、これに準じた形となっています。
アルケン「alkene」の場合は「炭素の数」の最後を「-ene」にするルールになっており、C6のアルケンならば「炭素が6=hexa」+「-ene」で「hexene(ヘキセン)」となります。 ただし例外は存在しており、C2は上記のように「エチレン(ethlene)」C3は「プロピレン(propylene)」と、そしてC4では「ブテン(butene)」と呼んでいます。
また、アルキン「alkyne」の場合も同様で最後を「-yne」にするルールになっており、C6のアルキンならば「炭素が6=hexa」+「-yne」で「hexyne(ヘキシン)」となります。ただし、C2化合物では上記のように「アセチレン(acethylene)と呼んでいます。
ただし、いずれもC1の化合物は存在しませんので、その点は注意してください(最低、炭素が二つ必要!)。
また、二重結合と三重結合の位置がアルケン・アルキンでは問題になります。
例えば、C4の「ブテン」を例に上げましょう。 ブテンは、以下のように上げられます。
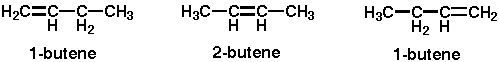
そう、左は1-ブテン、真ん中は2-ブテン..........そして、右も1-ブテンと呼びます。いずれも「二重結合の位置」が異なっています。
つまり、二重結合の位置を数字で表すことになっており、その数字は「二重結合を持つ炭素」が、「何番目にあるか」で変わってきます。 上記の例で見た場合、左は「一番左」に二重結合があるので、「一番最初」、つまり「1」の位置にあるという事で、「1-ブテン」となります。
同様に真ん中のものは「左から二番目」に二重結合があるので、「2」の位置にあるということで、「2-ブテン」となります。
.........では、右の物は? これは「3-ブテン」では無いのか? と思われるかも知れません。答えは違います。 これは、この「番号を付けるルール」の中に、「一番番号が若くなるように番号を付ける」というルールがあります。 つまり、左からは確かに「3番目」に二重結合がありますが、右から数えると「1番目」に二重結合が存在します。よって、「1-ブテン」と名前がつくことになります。
もし、この説明で納得できなければ...........左と右の化合物の構造をよ〜く見比べてみてください。 じつは一緒なんです。(^^;;
尚、上記のような物もじつは異性体であり、「二重結合の位置が違うだけで式は一緒」になっています。こういった異性体は「構造異性体」と呼んでいます。
三重結合も上記の例と一緒になりますので、省きます(三重結合の位置に数字をつける)。
う〜ん........やっぱり難しいのかな.........
さて、今回の「からこら」は如何だったでしょうか? 取りあえず、前回に引き続いて、有機化学の構造の基本について触れてみましたが........... 御感想、御質問をお待ちしています。
取りあえず今回で「単結合」「二重結合」「三重結合」について簡単ですが触れました。そして、各結合に関しての立体的な構造と、異性体についても簡単に触れてみましたが.............. 「こんなものなんだ」という認識をして頂ければOKです。
こちらの要望としましては、取りあえずこれらを覚えていただいたうえで、「異性体」という物を特に覚えていて欲しいです(頭の片隅でですよ、もちろん(^^;)。 何故か? そう、少し触れたのですが、これがまた非常に後の話に(構造の「マニアックな話」に)か関わってきます。 これが大事件に関わるんです、世の中を騒がした..............
ちなみに、前回と今回の話。本来は高校の科学の授業が数時間分と大学レベルでやる様な事が(本当に)若干入っていたりします(^^;;
さて、次回ですが、「環」、または「官能基」、それと「お絵書き」についてやってみようかと考えています。
それでは皆さん、風邪が流行の兆しだそうです。 体には気をつけてお過ごしくださいませ。
(1999/05/11記述)
前回分 次回分
からむこらむトップへ